hôm nay Tổng ca nhiễm Ca tử vong
Bộ Y tế vừa có quyết định phê duyệt có điều kiện vắc-xin cho nhu cầu cấp bách trong phòng, chống dịch bệnh COVID-19 theo quy định của Chính phủ quy định chi tiết một số điều và biện pháp thi hành Luật Dược.
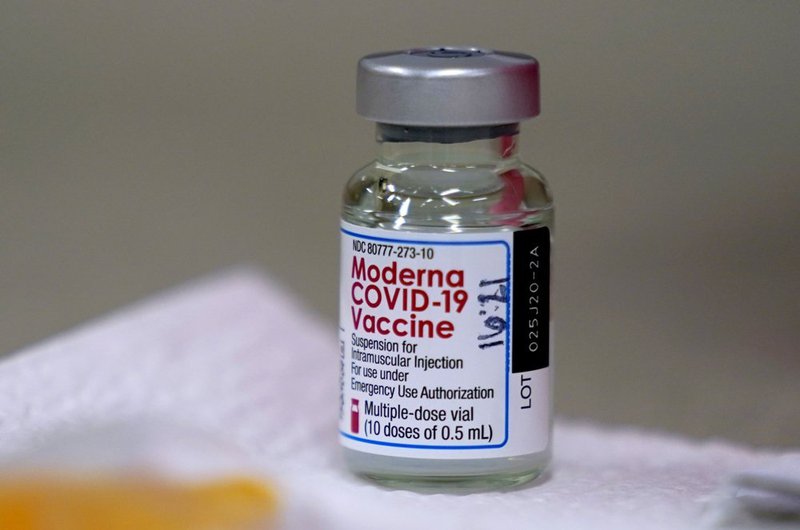
Vắc-xin Spikevax - tên khác là vắc-xin Moderna.
Tên vắc-xin: Spikevax (Tên khác là: COVID-19 vắc-xin Moderna).
Thành phần hoạt chất, nồng độ/hàm lượng: Mỗi liều 0,5ml chứa 100mcg mRNA (được nhúng trong các lipid nanoparticle SM-102).
Dạng bào chế: Hỗn dịch tiêm bắp.
Quy cách đóng gói: Hộp chứa 10 lọ đa liều; mỗi lọ đa liều chứa 10 liều 0,5ml.
Cơ sở sản xuất vắc-xin Spikevax khác có thể được thay đổi căn cứ vào khả năng cung cấp vắc-xin tại thời điểm cơ sở nhập khẩu nộp Hồ sơ đề nghị cấp phép nhập khẩu vắc-xin theo quy định.
Tên cơ sở đề nghị phê duyệt vắc-xin: Chi nhánh Công ty TNHH Zuellig Pharma Việt Nam.
Bộ Y tế yêu cầu Cục Quản lý Dược có trách nhiệm: Cấp phép nhập khẩu vắc-xin Spikevax theo quy định khi nhận được hồ sơ của cơ sở nhập khẩu; Thực hiện đúng quy định của pháp luật về quản lý nhập khẩu, quản lý chất lượng vắc-xin nhập khẩu.
Cục Khoa học công nghệ và Đào tạo có trách nhiệm: Lựa chọn đơn vị có đủ điều kiện đánh giá tính an toàn, hiệu quả của vắc xin trên cơ sở ý kiến tư vấn của Hội đồng tư vấn sử dụng vắc-xin, sinh phẩm y tế của Bộ Y tế trong quá trình sử dụng; Hướng dẫn, chỉ đạo đơn vị có đủ điều kiện quy định tại Điểm a Khoản này tổ chức thực hiện việc đánh giá tính an toàn, hiệu quả của vắc xin Spikevax trên cơ sở ý kiến tư vấn của Hội đồng tư vấn sử dụng vắc-xin, sinh phẩm y tế của Bộ Y tế trong quá trình sử dụng.
Cục Y tế Dự phòng thực hiện các trách nhiệm liên quan đến tiêm chủng vắc-xin Spikevax được quy định của Bộ trưởng Bộ Y tế về việc ban hành hướng dẫn tiếp nhận, bảo quản, phân phối và sử dụng vắc-xin phòng COVID-19.
Viện Kiểm định Quốc gia vắc-xin và sinh phẩm y tế có trách nhiệm kiểm định và cấp Giấy chứng nhận xuất xưởng lô vắc-xin Spikevax trước khi đưa ra sử dụng.
Quyết định của Bộ Y tế cũng nêu rõ: Các điều kiện đi kèm việc phê duyệt vắc-xin Spikevax cho nhu cầu cấp bách trong giai đoạn phòng, chống dịch bệnh COVID-19:
Vắc-xin Spikevax được phê duyệt dựa trên dữ liệu an toàn, chất lượng và hiệu quả do Chi nhánh Công ty TNHH Zuellig Pharma Việt Nam cung cấp cho Bộ Y tế Việt Nam tính đến ngày 23/6/2021 và cam kết của Chi nhánh Công ty TNHH Zuellig Pharma Việt Nam về tính chính xác của các tài liệu đã cung cấp cho Bộ Y tế Việt Nam.
Chi nhánh Công ty TNHH Zuellig Pharma Việt Nam có trách nhiệm phối hợp với cơ sở sản xuất vắc-xin phản hồi kịp thời các yêu cầu từ Bộ Y tế Việt Nam để bổ sung thêm dữ liệu hoặc các yêu cầu khác có liên quan đến vắc-xin Spikevax và chủ động cung cấp, cập nhật các thông tin mới có liên quan đến vắc-xin Spikevax cho Bộ Y tế Việt Nam trong suốt quá trình phát triển sản phẩm;
Chi nhánh Công ty TNHH Zuellig Pharma Việt Nam chịu trách nhiệm phối hợp với cơ sở sản xuất vắc-xin đảm bảo các điều kiện sản xuất tại cơ sở sản xuất vắc-xin Spikevax nhập khẩu vào Việt Nam và đảm bảo an toàn, hiệu quả và chất lượng của lô vắc-xin Spikevax nhập khẩu vào Việt Nam; Phối hợp với đơn vị phân phối, sử dụng vắc xin Spikevax triển khai hệ thống cảnh giác dược toàn diện đối với vắc-xin này tại Việt Nam theo quy định của pháp luật;
Phối hợp với Cục Khoa học công nghệ và Đào tạo và đơn vị có đủ điều kiện tổ chức thực hiện việc đánh giá tính an toàn, hiệu quả của vắc-xin Spikevax trên cơ sở ý kiến tư vấn của Hội đồng tư vấn sử dụng vắc-xin, sinh phẩm y tế của Bộ Y tế trong quá trình sử dụng;
Phối hợp với Viện Kiểm định Quốc gia vắc-xin và sinh phẩm y tế trong việc kiểm định các lô vắc-xin Spikevax trước khi đưa ra sử dụng; phối hợp với Cục Y tế dự phòng hướng dẫn việc bảo quản, phân phối và sử dụng vắc-xin Spikevax cho các cơ sơ tiêm chủng.
Bộ Y tế cũng yêu cầu Chi nhánh Công ty TNHH Zuellig Pharma Việt Nam phải phối hợp với Bộ Y tế Việt Nam để triển khai quản trị rủi ro đối với vắc-xin Spikevax trong suốt quá trình lưu hành tại Việt Nam. Đồng thời, việc sử dụng vắc-xin Spikevax phải theo hướng dẫn của Bộ Y tế Việt Nam.
Như vậy, đến nay đã có 5 loại vắc-xin được Bộ Y tế phê duyệt có điều kiện vắc-xin cho nhu cầu cấp bách trong phòng, chống dịch bệnh COVID-19 gồm: Vắc-xin Astra Zeneca; Vắc-xin Sputnick; Vắc-xin Pfizer; Vắc-xin Vero Cell và Vắc-xin Spikevax (Tên khác là: COVID-19 vắc-xin Moderna).