Vắc-xin có tên là covovax TM , được sản xuất bởi Viện Huyết thanh của Ấn Độ theo giấy phép của Novavax, và là một phần danh mục vắc-xin của COVAX. Điều này đã tạo ra một động lực rất cần thiết cho những nỗ lực không ngừng nhằm tiêm chủng cho nhiều người hơn ở các quốc gia có thu nhập thấp hơn.
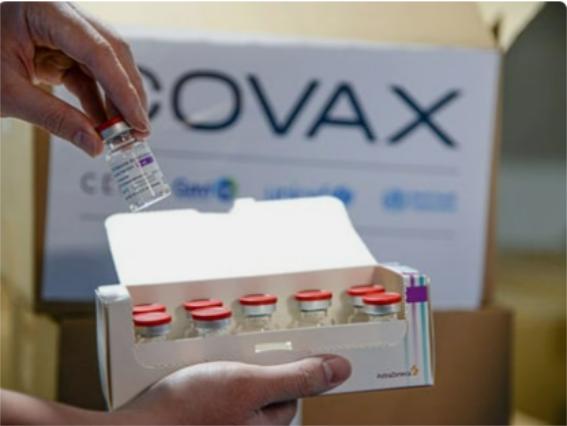
Thêm một vắc-xin COVID-19 được WHO cho phép sử dụng khẩn cấp.
Quy trình EUL của WHO đánh giá chất lượng, độ an toàn và hiệu quả của vắc-xin COVID-19 và là điều kiện tiên quyết để cung cấp vắc-xin cho COVAX. Nó cũng cho phép các quốc gia xúc tiến sự chấp thuận theo quy định của mình để nhập khẩu và quản lý vắc-xin COVID-19.
Tiến sĩ Mariângela Simão, Trợ lý Tổng giám đốc WHO về Tiếp cận Thuốc và Sản phẩm Y tế cho biết: "Ngay cả khi các biến thể mới xuất hiện, vắc-xin vẫn là một trong những công cụ hiệu quả nhất để bảo vệ con người chống lại bệnh tật nghiêm trọng và tử vong do SARS-COV-2.
Danh sách này nhằm mục đích tăng khả năng tiếp cận, đặc biệt là ở các quốc gia có thu nhập thấp, 41 trong số đó vẫn chưa thể tiêm vắc-xin cho 10% dân số của họ, trong khi 98 quốc gia chưa đạt 40%".
Covovax TM được đánh giá theo quy trình EUL của WHO dựa trên việc xem xét dữ liệu về chất lượng, an toàn và hiệu quả, kế hoạch quản lý rủi ro, tính phù hợp theo chương trình và kiểm tra địa điểm sản xuất do Tổng kiểm soát dược phẩm của Ấn Độ thực hiện.
Nhóm Cố vấn Kỹ thuật cho Danh sách sử dụng khẩn cấp (TAG-EUL) do WHO triệu tập, bao gồm các chuyên gia từ khắp nơi trên thế giới, đã xác định rằng vắc-xin đáp ứng các tiêu chuẩn của WHO về bảo vệ chống lại COVID-19. Lợi ích của vắc-xin vượt xa bất kỳ rủi ro nào và vắc-xin có thể được sử dụng trên toàn cầu.
Covovax TM cần hai liều và ổn định ở nhiệt độ tủ lạnh từ 2 đến 8° C.
Vắc-xin vẫn là một trong những công cụ hiệu quả nhất để bảo vệ chống lại bệnh tật nghiêm trọng và tử vong do SARS-COV-2.
Quy trình liệt kê sử dụng khẩn cấp (EUL) đánh giá tính phù hợp của các sản phẩm y tế mới trong các trường hợp khẩn cấp về sức khỏe cộng đồng. Mục tiêu là cung cấp thuốc, vắc-xin và chẩn đoán nhanh nhất có thể để giải quyết tình trạng khẩn cấp đồng thời tuân thủ các tiêu chí nghiêm ngặt về an toàn, hiệu quả và chất lượng. Đánh giá cân nhắc mối đe dọa do trường hợp khẩn cấp gây ra cũng như lợi ích tích lũy từ việc sử dụng sản phẩm trước mọi rủi ro tiềm ẩn.
Là một phần của quy trình EUL, công ty sản xuất vắc-xin phải cam kết tiếp tục tạo ra dữ liệu để có thể cấp phép đầy đủ và WHO đã sơ tuyển vắc-xin. Quá trình sơ tuyển của WHO sẽ đánh giá các dữ liệu lâm sàng bổ sung được tạo ra từ các thử nghiệm vắc-xin và triển khai trên cơ sở luân phiên để đảm bảo vắc-xin đáp ứng các tiêu chuẩn cần thiết về chất lượng, an toàn và hiệu quả để cung cấp rộng rãi hơn.